ATOMÍSTICA
“OBSERVANDO AQUILO
QUE NINGUÉM OBSERVA, VOCÊ SABERÁ AQUILO QUE NINGUÉM SABE!”
REVISÃO DO 1º SEMESTRE PARA O ENEM – PARTE 2
21- (PUC-MG-2006) Observe com atenção as espécies I a IV representadas
abaixo:
I. 12 prótons, 12
nêutrons, 11 elétrons.
II. 12 prótons, 11 nêutrons, 12 elétrons.
III. 11 prótons, 12 nêutrons, 12 elétrons.
IV. 12 prótons, 12 nêutrons, 12 elétrons.
Assinale
a opção cujas espécies representam íons.
a)I
e III apenas.
b)I,
II, III e IV.
c)II, III e IV apenas.
d)I,
II e III apenas.
22- (UFSCAR-2007) Um modelo relativamente simples para o átomo o
descreve como sendo constituído por um núcleo contendo prótons e nêutrons, e
elétrons girando ao redor do núcleo. Um dos isótopos do elemento Ferro é
representado pelo símbolo 26Fe56 . Em alguns compostos, como a hemoglobina do sangue, o Ferro
encontra-se no estado de oxidação 2+ (Fe2+).
Considerando-se
somente o isótopo mencionado, é correto afirmar que no íon Fe2+:
a) o número de
nêutrons é 56, o de prótons é 26 e o de elétrons é 24.
b) o número de
nêutrons + prótons é 56 e o número de elétrons é 24.
c) o número de
nêutrons + prótons é 56 e o número de elétrons é 26.
d) o número de
prótons é 26 e o número de elétrons é 56.
e) o número de
nêutrons + prótons + elétrons é 56 e o número de prótons é 28.
23- (UEM-CVU-2006) Assinale a alternativa incorreta:
a) Um próton tem
massa equivalente à massa de 1836 elétrons.
b) Um nêutron possui
carga elétrica nula ou zero.
c) A carga de um
elétron é aproximadamente 1,6 x 10-19 Coulombs.
d) O núcleo atômico
possui carga negativa e concentra aproximadamente toda a massa do átomo.
e) Em um átomo
neutro, o numero de prótons é igual ao número de elétrons.
24- (UFAM-2007) Sobre o modelo atômico atual podemos afirmar verdadeiramente
que:
a) Os prótons só
apresentam características ondulatórias.
b) O núcleo é uma
região eletricamente neutra.
c) Os nêutrons, por
não terem carga, neutralizam a carga do núcleo.
d) Os elétrons apresentam característica de onda e de partícula.
e) A maior parte da
massa atômica é preenchida pela eletrosfera.
25-
(UNIFOR-2007) Considere as espécies químicas:
9Be,9Be+2................
número atômico 4
24Mg,
24Mg+2.......... número atômico 12
19F,
19F-1................... número atômico 9
I. Têm igual número de
prótons no núcleo as espécies 9Be,9Be+2.
II. Têm igual número de
elétrons na eletrosfera as espécies 24Mg, 24Mg+2.
III. Têm igual número de
carga as espécies 19F, 19F-1.
IV. Dentre essas
espécies a que tem maior número de nêutrons no núcleo atômico é o 24Mg,
24Mg+2.
V. Dentre essas
espécies a que tem maior número de elétrons na eletrosfera é o19F-1.
Está correto que se afirma
SOMENTE em:
a)I e IV.
b)I e V.
c)II e III.
d)II e IV.
e)IV e V.
26-
(UFCG-2007) Na identificação de um átomo ou íon
inclui-se o seu símbolo (X), o número de massa (A), o número atômico (Z) e o
número de carga (n+ ou n-). Na tabela abaixo são dados exemplos de
identificação de seis átomos/íons.
Com base nestas
informações, assinale dentre as alternativas abaixo a afirmação INCORRETA.
a) R tem um número de
nêutrons igual a 82 e um número de elétrons igual a 54.
b) Y tem um elétron e
G não tem elétrons.
c) T tem um próton.
d) M e Q são isótonos.
e) Q e G são isóbaros.
27-
(UNIFOR-2006) O íon 2412Mg+2
e o átomo neutro do gás nobre neônio
têm em comum:
a) o número de
elétrons.
b) o numero de massa.
c) o numero atômico.
d) a massa atômica
absoluta.
e) a carga elétrica total.
28-
(UFJF-2007) Na tabela abaixo, qual é a alternativa que
melhor preenche as lacunas nas colunas de I a IV RESPECTIVAMENTE?
a) 20, I, S, 17.
b) 18, I, S, 18.
c) 20, I-, O-2, 17.
d) 22, I, O, 18.
e) 18, I-, S-2,
18.
29-
(UFMG-2007) Analise este quadro, em que se apresenta o
número de prótons, de nêutrons e de elétrons de quatro espécies químicas:
Considerando-se as quatro
espécies apresentadas, é INCORRETO
afirmar que:
a) I é o cátion H+.
b) II é o ânion F-.
c) III tem massa molar
de 23 g/mol.
d) IV é um átomo
neutro.
30-
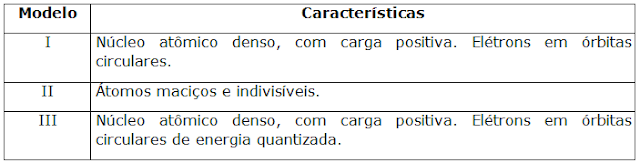
(PUC-PR-2007) Alguns modelos atômicos que conhecemos
foram propostos por Dalton, Rutherford e Bohr no século XIX. Algumas das
características de cada um desses modelos estão apresentadas no quadro abaixo:
Selecione a alternativa
abaixo que apresenta a associação correta
modelo/cientista:
a)
I / Rutherford; II
/ Dalton; III / Bohr.
b)
I / Bohr; II /
Dalton; III / Rutherford.
c)
I / Dalton; II /
Bohr; III / Rutherford.
d)
I / Dalton; II /
Rutherford; III / Bohr.
e)
I / Rutherford; II
/ Bohr; III / Dalton.
31-
(UESPI-2007) Qual das descrições dos modelos atômicos
descritos está incorreta?
a) O Modelo atômico de Dalton: Em 1808, o
cientista inglês John Dalton apresentou sua teoria sobre a constituição atômica
da matéria. Dalton descrevia a matéria a partir de algumas hipóteses: tudo que
existe na natureza é composto por diminutas partículas denominadas átomos; os
átomos são indivisíveis e indestrutíveis; existe um número pequeno de elementos
químicos diferentes na natureza; reunindo átomos iguais ou diferentes nas
variadas proporções, podemos formar todas as matérias do universo conhecido.
b) O Modelo de
Thomson: O
modelo proposto por J. J. Thomson, em 1898, baseava-se na idéia de que o átomo
era uma esfera de eletricidade positiva, onde estavam submersas partículas
negativas denominadas elétrons. Foi Thomson que lançou a idéia de que o átomo
era um sistema descontínuo, portanto, divisível.
c) Modelo atômico de
Rutherford:
No final do século XIX, o físico neozolandês Ernest Rutherford começou a
trabalhar com a radioatividade. Os experimentos realizados por Rutherford, com
o fenômeno da radioatividade, permitiram a elaboração de um novo modelo
atômico. Neste novo modelo, o átomo ocuparia um volume esférico e possuiria um
núcleo, ressaltando que o núcleo possuía a maior parte da massa do átomo, bem
como teria uma carga positiva. A região externa ao núcleo estaria ocupada pelos
elétrons numa região denominada eletrosfera. Os elétrons estariam em movimento
em torno do núcleo, na eletrosfera.
d) Modelo atômico de
Bohr:
Em 1913, Niels Bohr propôs um novo modelo atômico. Para Bohr, os elétrons giram
em torno do núcleo de forma circular e com diferentes níveis de energia,
salientando que os átomos possuíam um núcleo positivo que está rodeado por
cargas negativas; a eletrosfera estaria dividida em níveis eletrônicos, também
chamados por Bohr de orbital atômico (OA). Nestes AO, os elétrons apresentariam
energias constantes. Estes elétrons poderiam saltar para orbitais de mais alta
energia, retornando ao seu estado fundamental, após a devolução da energia que
havia sido ganha para o salto, emitindo um fóton de luz equivalente.
e) Modelo atômico de
Bohr:
O modelo atômico atual é um modelo matemático-probabilístico embasado, fundamentalmente,
nos princípios da Incerteza de Heinsenberg e no da Dualidade partícula-onda de
Louis de Broglie. Além disso, Erwin Schröndinger (1887-1961), a partir desses
dois princípios, criou o conceito de Orbital (regiões de probabilidade). Por
fim, Paul Dirac calculou essas regiões, determinando, então, os quatro números
quânticos (principal, secundário, magnético e de spin).
32-
(UECG-2006) Trabalhando com as informações até então
conhecidas, Bohr foi capaz de explicar as raias do espectro do átomo de
hidrogênio. Ele propôs um modelo para o átomo que mantinha o núcleo do modelo atômico de Rutherford. O modelo
atômico de Böhr tem como base o seguinte princípio:
a) o elétron pode
girar nas órbitas de qualquer raio.
b)
o elétron pode girar somente nas órbitas de raios específicos.
c)
a diferença de
energia entre as
órbitas aumenta à
medida que eles se afastam do
núcleo.
d) enquanto o elétron
estiver girando na mesma órbita, ele não emite fóton, mas pode absorver a
radiação eletromagnética.
e) quando o
elétron transita para
órbita mais afastada
do núcleo, ocorre emissão de luz.
33-
(UEM-2006) Assinale a alternativa incorreta:
a) A todo elétron em
movimento está associada uma onda característica (princípio da dualidade ou de
De Broglie).
b) Não é possível
calcular a posição e a velocidade de um elétron em um mesmo instante (princípio
da incerteza ou de Heisenberg).
c) Orbital é a região
do espaço ao redor do núcleo onde é máxima a probabilidade de se encontrar um
determinado elétron.
d) Ao preencher os
orbitais de um mesmo subnível, todos os orbitais devem receber seu primeiro
elétron, e só depois cada orbital irá receber seu segundo elétron.
e) O número máximo de
orbitais que podem existir no nível energético M é 4.
34-
(UFPR-2006) Sobre o átomo de antimônio (
), considere as seguintes afirmativas:
I. É um elemento
químico que pertence ao 4º período da tabela periódica.
II. Esse elemento
pertence à família do nitrogênio (
).
III.
A distribuição eletrônica dos seus elétrons termina em 5p3.
IV. O elétron mais
energético desse átomo encontra-se em um orbital degenerado.
V. O número quântico
do último elétron é Ψ5,0,0,+1/2.
Assinale a alternativa correta.
a) Somente as
afirmativas II, III e IV são verdadeiras.
b) Somente as
afirmativas I e II são verdadeiras.
c) Somente as
afirmativas II e III são verdadeiras.
d) Somente as
afirmativas III, IV e V são verdadeiras.
e) Somente as
afirmativas I e V são verdadeiras.
35-
(CEFET-PR-2006) Qual alternativa apresenta corretamente os
quatro números quânticos do elétron colocado no orbital 2pz,
representado no nível energético abaixo?
a) n = 2; l = 1; m =
+1; ms = + ½.
b) n = 2; l = 2; m =
1; ms = + ½.
c) n = 2; l = 1; m =
2; ms = + ½.
d) n = 2; l = 0; m =
+1; ms = + ½.
e) n = 2; l = 0; m =
0; ms = + ½.
36-
(UFV-2006) Na produção de cerâmicas e vidros coloridos geralmente
são empregados compostos de metais de transição. A cor final do material
depende, entre outros fatores, dos estados de oxidação dos metais presentes,
como exemplificado na tabela:
Sobre estes metais, é INCORRETO afirmar que:
a) o cátion Cr3+ possui 21 elétrons.
b) o número de prótons
no Fe3+ é igual a 26.
c) no cátion Fe3+ o número de elétrons é igual ao número de
prótons.
d) a distribuição
eletrônica no estado fundamental em camadas para o Cu2+ é 2, 8, 17.
e) na tabela periódica
eles estão no quarto período.
37-
(UNICAP-2005) Os três números quânticos de um elétron em
um átomo de hidrogênio em um determinado estado são n=4, l=2, m=-1. A partir destes dados,
podemos concluir:
0-0) o tamanho
atômico do hidrogênio diminuiu, pois
n aumentou.
1-1) o átomo ficou mais estável.
2-2) o
átomo, para voltar ao estado fundamental, absorve energia.
3-3) esse elétron se encontra em orbital 4d.
4-4) n determina o número quântico principal.
38-
(UNICAP-2005) Considerando a representação do elétron
mais energético de um átomo X, conforme indicado abaixo, e respeitando-se a
regra de Hund, afirma-se:
(Ar) 3d104s1; 18Ar38
(Obs.: por convenção:
-1/ 2 para o 1º elétron)
0-0) o átomo apresenta um total de 15 elétrons de
spin -1/2.
1-1) seu número atômico é 29.
2-2) é um elemento de transição externa.
3-3) gera apenas cátions monovalentes.
4-4) o
átomo apresenta apenas seis elétrons com número quântico magnético +1.
39-
(UNICAP-2003) Para cada um dos seguintes átomos Zn, Cℓ,
Aℓ e Cu, no estado fundamental, o tipo de orbital (por exemplo, 1s, 2p, 3d, 4f ) do qual um elétron poderia
ser removido para torná-lo um íon +1
será:
(Números atômicos: Aℓ =
13; Cℓ = 17; Cu = 29 e Zn = 30)
0-0) o Zn no orbital 4s;
1-1) o Cℓ no orbital 3p;
2-2) o Aℓ no orbital 2s;
3-3) o Cu no orbital 4s;
4-4) o Zn no orbital 3d.
40- (PUC-RIO-2007)
Sobre a estrutura atômica, configuração eletrônica e periodicidade química, é
correto afirmar que:
a) quando o elétron é
excitado e ganha energia, ele salta de uma órbita mais externa para outra mais
interna.
b) sendo o orbital a
região mais provável de se encontrar o elétron, um orbital do subnível p poderá
conter no máximo de seis elétrons.
c) o íon Sr2+ possui configuração eletrônica 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6.
d) devido à sua carga
nuclear, o raio atômico do sódio é menor do que o do cloro.
e) a energia para
remover um elétron do átomo de Mg (1ª energia de ionização) é maior do que
aquela necessária para remover um elétron do íon de Mg1+ (2ª energia de ionização).
41-
(UFAM-2007) Considere um elétron, em um átomo que
possui cinco níveis principais de energia. A única alternativa errada é:
a) Caso o átomo seja
de um metal de transição, poderá apresentar a penúltima camada, com subcamada
de número azimutal igual a dois, incompleta.
b) Haverá absorção de
energia, seguido de ionização do átomo, se o elétron saltar da última órbita
para n=∞.
c) Haverá absorção de
energia, em determinado comprimento de onda, se houver salto eletrônico de n=5
para n=4.
d) Em seu último nível
principal alguns dos elétrons não podem apresentar número azimutal igual a
três.
e) Em todos os cinco
níveis haverá elétrons com número azimutal igual a zero.
PELO PROFESSOR EUDO ROBSON
A REVISÃO COMPLETA COM O GABARITO
ESTÃO DISPONÍVEIS NO SITE:






Sem comentários:
Enviar um comentário