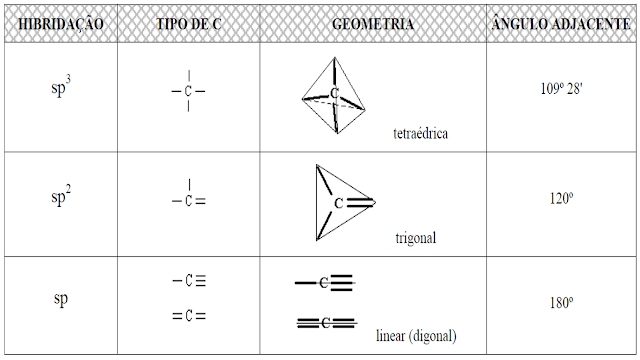
EXERCÍCIOS DE QUÍMICA ORGÂNICA – LIGAÇÕES
01- (UEPB-2005). Analise as afirmativas abaixo:
I. O carbono
estabelece quatro ligações covalentes comuns, mesmo tendo apenas dois elétrons desemparelhados no estado fundamental e este
fenômeno é explicado pela teoria das tensões de Baeyer.
II. A classificação de carbonos em primário,
secundário e terciário não se aplica aos carbonos sp2 e sp.
III. Tem-se como principais características dos compostos
orgânicos o fato deles, em sua maioria, possuírem ligações exclusivamente
covalentes, apresentarem pontos de fusão relativamente baixos (quando
comparados com os compostos inorgânicos) e serem maus condutores de corrente
elétrica.
IV. Uma cadeia de
compostos orgânicos é classificada como aromática quando as ligações ð aparecem
em número par.
Está
(ão) correta (s) apenas
a)
I, II e III.
b)
II e III.
c)
II e IV.
d)
IV
e)
III.
02- (PUC -PR 2008 - Modifucada). Em 1828, um aluno de Berzélius, Friedrich Wöhler,
derrubou uma teoria X, com a sintetização em laboratório da ureia, um composto
integrante do suor e da urina dos animais, pelo simples aquecimento de um
composto orgânico extraído de minerais, o cianato de amônio, (NH4OCN). Com
relação ao texto e a fórmula da ureia abaixo demonstrada, assinale a verdadeira
a) Existem pelo menos 6 ligações σ (S – P).
b) Existem hoje uma quantidade muito maior de compostos inorgânicos do que
orgânicos.
c) O nox do carbono varia de -3 até +4.
d) Existem 1 ligação pi e 4 ligações do tipo sigma, sendo a hibridação do
átomo de carbono sp2.
e) A teoria da Força Vital de Jacob Berzélius, diz que
os compostos orgânicos precisavam de uma força maior (vida) para serem
sintetizados.
03-
(UFG-2006) ...o carbono é tetravalente. A.
Kekulé, 1858
A distribuição eletrônica do
carbono, no estado fundamental, entretanto, mostra que ele é bivalente. Para
que o carbono atenda ao postulado de Kekulé, ele sofre
a) Ressonância.
b) Isomeria.
c) Protonação.
d) Hibridização.
e) Efeito indutivo.
04- (UFPB – 2008). Um mesmo elemento pode apresentar-se de diversas
formas na natureza, as quais são chamadas de alotrópicas, e o referido fenômeno
conhecido como alotropia. O diamante e o grafite, representados a seguir, são
exemplos de formas alotrópicas do carbono.
Em
relação ao diamante e ao grafite, é correto afirmar:
a) Os átomos de carbono possuem o mesmo tipo de hibridização no diamante e
no grafite.
b) Essas formas alotrópicas possuem as mesmas propriedades físicas.
c) Os átomos de carbono, no diamante, estão separados por ângulos de
109°28'.
d) Os átomos de carbono possuem hibridização sp2 e sp3,
respectivamente, no diamante e no grafite.
e) Os átomos de carbono formam ligações sigma C − C do tipo sp3
– sp3, tanto no diamante quanto no grafite.
05- (UFPI-2008) O Viagra, um dos medicamentos mais conhecidos no mundo, indicado para o
tratamento da disfunção erétil, tem como princípio ativo o sildenafil
(estrutura abaixo), na forma de citrato:
Nesta
molécula, o número de átomos de carbono com hibridação sp2, é igual
a:
a)
8
b)
9
c)
10
d)
11
e)
12
06- (UECE-2008). Uma das substâncias contidas nas bebidas alcoólicas é o etanol. Quando o
etanol é carregado pelo sangue e chega ao cérebro, ele estimula os neurônios a
liberarem uma quantidade extra de serotonina, que deixa a pessoa desinibida e
eufórica.
De acordo com sua estrutura,
mostrada acima, a serotonina possui ligações sigma e pi, cujas
quantidades são, respectivamente:
a) 26 e 4
b) 18 e 8
c) 22 e 4
d) 18 e 4
07- (USS-2006). A sarcomicina é um quimioterápico
utilizado no tratamento do câncer, cuja fórmula estrutural é representada por:
Sua molécula apresenta:
a) 6 átomos de carbono, 7 átomos de hidrogênio e 3 átomos de oxigênio.
b) 2 átomos de carbono primário, 3 átomos de carbono secundário e 1 átomo
de carbono terciário.
c) 18 ligações sigma e 3 ligações pi.
d) 5 ligações covalentes apolares e 15 ligações covalentes polares.
e) 70% em massa de carbono, 25% em massa de hidrogênio e 5% em massa de
oxigênio.
08-
(UFPE- 2007) A partir da estrutura do composto abaixo,
podemos afirmar que:
0-0) os
carbonos 1 e 2 apresentam hibridização sp2.
1-1) os
carbonos 3 e 4 apresentam hibridização sp3.
2-2) o carbono 5 apresenta
hibridização sp.
3-3)
os carbonos 1 e 2 apresentam duas ligações
pi entre si.
4-4)
os carbonos 3 e 4 apresentam duas ligações pi e uma sigma, entre si.
09-
(UFPI-2006) A cafeína, um estimulante presente no café e
chocolate, possui a seguinte fórmula estrutural:
Com
relação à cafeína, assinale a alternativa correta.
a) Possui fórmula mínima
C4H5N2O.
b) Tem carbono com
hibridação sp.
c) Todas as ligações
presentes são de natureza apolar.
d) Todos os átomos de
carbono possuem hibridação sp2.
e) Cada átomo de
oxigênio possui três pares de elétrons isolados.
10-
(UNICENP-2008). Em qual das alternativas abaixo a hibridação
(ou hibridização) dos orbitais do carbono está correta?
Substância
|
Fórmula
Molecular
|
Hibridação
|
|
a)
|
Metano
|
CH4
|
sp2
|
b)
|
Formaldeído
|
CH2O
|
sp3
|
c)
|
Tetracloreto de Carbono
|
CCℓ4
|
sp
|
d)
|
Cianeto de Hidrogênio
|
HCN
|
sp2
|
e)
|
Metanol
|
CH3OH
|
sp3
|
11-
(UEM-2007). Considerando os compostos I e II, assinale a alternativa
correta.
a) O composto II não é
aromático, pois possui 8 elétrons pi.
b) O composto I não é
aromático, pois possui um carbono sp3 com quatro ligações simples.
c) O composto II tem
anel planar, pois todos os carbonos do anel são sp2.
d) No composto I, todas
as ligações C-C e C-H fazem ângulos de 120o entre si.
e) No composto II,
existem sete carbonos com hibridização sp2 e um com hibridização sp.
12-
(UFPB-2006) Uma das substâncias líquidas cristalinas
mais eficientes, empregadas na produção de Visores de Cristal Líquido (LCD), é
o composto
Em relação a esse composto, é INCORRETO afirmar:
a) A fórmula molecular é
C18H29N.
b) O
número de átomos de carbono primário, secundário e terciário é,
respectivamente, 2, 12 e 4.
c) O número de átomos de
carbono com hibridização sp3, sp2 e sp é,
respectivamente, 15, 2 e 1.
d) O número de ligações
pi (p) é igual a 3.
Apenas
os átomos de carbono terciários possuem geometria tetraédrica.
PELO PROFESSOR EUDO ROBSON
GABARITO E MAIS QUESTÕES ESTÃO
DISPONÍVEIS PARA DOWNLOALD GRATUÍTO NO
SITE:
www.universodaquímica.com