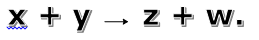01. (Pouso Alegre) A reação entre zinco e
ácidos em solução pode ser representada pela equação:
Zn
+ 2H3O+ --------------
Zn+2 + H2 + 2H2O
A velocidade da reação será maior se usarmos:
(a) zinco em pó.
(b) zinco em barra.
(c) água destilada em vez de ácidos.
(d) água pesada (D2O) em vez de ácidos.
(e) zinco em tabletes.
02. (F. C. Chagas) No estudo cinético da
decomposição de um composto x obteve-se o seguinte gráfico da variação da
concentração de x com o tempo:
A velocidade média de decomposição de x é dada por:
03. (F. C. Chagas) Um bico de Bunsen está
consumindo 2,24 litros/minuto de butano (medido nas CNTP). Em virtude da reação
de combustão, a velocidade de formação do dióxido de carbono será de
C4H10
+ 13/2O2___________4CO2 + 4 H2O
(a) 0,10 mol/minuto.
(b) 0,20 mol/minuto.
(c) 0,30 mol/minuto.
(d) 0,40 mol/minuto.
(e) 0,50 mol/minuto.
04. (Puccamp) A combustão do propano
obedece à equação:
C3H8
+ 5O2 _______3CO2+4H2O
Havendo consumo de 0,5 mols de moléculas do
hidrocarboneto em 15 minutos, a velocidade da reação, em mols de CO2/min, será:
(a) 0,033.
(b) 0,3.
(c) 0,1.
(d) 0,2.
(e) n.d.a.
06.
(F. Luís Meneghel) Considere a reação:
Admitindo-se que o substância x reage conforme a
tabela:
Determine a velocidade média da reação em relação a x,
no intervalo entre 0 e 20s, em mols/s:
(a) 0,05.
(b) 0,06.
(c) 0,125.
(d) 0,13.
(e) 0,3.
07. (F. C. Chagas) A velocidade da reação
entre nitrogênio e hidrogênio, produzindo gás amoníaco, é função:
(a) somente da concentração dos reagentes.
(b) somente da temperatura em que é efetuada.
(c) somente de pressão a que são submetidos os
reagentes.
(d) somente da presença de um catalisador adequado.
(e) de todos os fatores acima mencionados.
08. (UF. São Carlos) Os seguintes dados são
para a reação de decomposição do peróxido de hidrogênio a uma certa
temperatura:
2H2O2(aq) ----------
2H2O(L)+ O2(g)
As velocidades médias de decomposição do peróxido de
hidrogênio nos Intervalos 0 a 10 min, 0 a 20 min e 20 a 30 min são
respectivamente, em mol/litro min:
min:
09. (F. C. Chagas) Considere os seguintes
fatores: temperatura, pressão, estado de divisão, concentração e catalisador.
Quantos desses fatores podem alterar e velocidade de uma reação química?
(a) 1.
(b) 2.
(c) 3.
(d) 4.
(e) 5.
10. (EFO-Alfenas) Abaixo temos alguns
termos e seus respectivos conceitos:
Associando-se a primeira coluna com os conceitos da
segunda temos:
(a) 1D, 2C, 3B, 4A.
(b) 1D, 2A, 3C, 4B.
(c) 1C, 2B, 3D, 4A.
(d) 1C, 2D, 3B, 4A.
(e) 1A, 2B, 3D, 4C.
11. (UF-Viçosa) Uma reação importante na
química que trata da poluição é a reação entre os gases monóxido de nitrogênio,
NO, e oxigênio, O2, produzindo dióxido de nitrogênio, NO2,
segundo a equação balanceada:
processando-se a reação representada acima em um
recipiente fechado e em condições tais que a velocidade da reação direta, V1,
obedeça à equação:
de quanto ficará multiplicada a velocidadeV1,
duplicando-se simultaneamente as concentrações de NO e O2?
(a) 2.
(b) 4.
(c) 5.
(d) 8.
(e) 16.
12.
(F. Zona Leste) “A velocidade de uma reação, num certo instante, a cada
temperatura, é proporcional ao produto das concentrações molares dos
reagentes”. Esta é a lei da ação das massas, também conhecida por:
(a) Arrhenius
(b) Van de Waals.
(c) Newton.
(d) Guldberg-Waage.
(e) Rutherford.
13. (UF-Uberlândia) Considere o gráfico de
uma reação:
A partir dele forem faltas as seguintes afirmativas:
I. A energia de ativação é 15 kcal.
II. A reação é endotérmica.
III. A reação é espontânea.
Você pode concluir que desses afirmativas:
(a) todas são falsas.
(b) todas são corretas.
(c) somente II e III são corretas.
(d) somente I e II são corretas.
(e) somente I e III são corretas.
(F.
Zona Leste) Para as questões 14 e 15 considere o
esquema:
1/2N2(g)
+ O2(g) --------- NO2(g) ΔH=+8,10 kcal
14.
A variação de entalpia é representada por:
(a) 5.
(b) 4.
(c) 3.
(d) 2.
(e) 1.
15.
Quando 3 mols de NO2(g) são produzidos, a quantidade de energia
absorvida é:
(a) 8,10 kcal.
(b) 16,20 kcal.
(c) 24,3 kcal.
(d) 32;4 kcal.
(e) 48,6 kcal.
16. (F. C. Chagas) Considere os seguintes
dados relacionados à velocidade inicial da reação
Qual a ordem dessa reação?
(a) 1
(b) 1,5
(c) 2
(d) 2,5
(e) 3
(F. C. Chagas) As questões 17 a 19 se relacionam com o esquema abaixo reproduzido
17.
A variação de entalpia da reação:
é igual a:
(a) +30 kcal/mol
(b) -30 kcal/mol
(c) +70 kcal/mol
(d) +50 kcal/mol
(e) -100 kcal/mol
18.
A energia de ativação da reação

quando ela se processa sem o auxílio do
catalisador é:
(a) +30 kcal/mol
(b) -30 kcal/mol
(c) +70 kcal/mol
(d) +50 kcal/mol
(e) -100 kcal/mol
19.
A energia de ativação da reação
quando ela se processa com o auxílio do
catalisador é:
(a) +30 kcal/mol
(b) -30 kcal/mol
(c) +70 kcal/mol
(d) +50 kcal/mol
(e) -100 kcal/mol
20. (MACK-SP) Dada a equação da reação
elementar
H2
+ Cl2 ------------------2HCl
se reduzirmos simultaneamente a concentração de H2 e Cl2 à metade, mantendo
constantes todos os outros fatores, a velocidade da reação:
(a) quadruplica.
(b) reduz-se a 1/4 da inicial.
(c) dobra.
(d) reduz-se à metade.
(e) permanece igual a inicial.
21. (Uberaba) Considere os diagramas de
energia abaixo, onde os reagentes estão representados por R e os produtos por
P. Qual deles indica a reação R  P que apresenta menor energia de ativação?
P que apresenta menor energia de ativação?
22.
(PUC) A reação
N2(g)+3H2(g)------ 2NH3(g)
está se processando em um recipiente fechado, em
condições tais que a sua velocidade obedece à equação:
Duplicando-se as pressões parciais do nitrogênio e do
hidrogênio, permanecendo as demais condições constantes, verifica-se que a
velocidade da reação:
(a) permanecerá a mesma.
(b) irá duplicar.
(c) irá quadruplicar.
(d) ficará 8 vezes maior.
(e) ficará 16 vezes maior.
23. (F. C. Chagas) A reação de decomposição
do hipoclorito de sódio é representada por:
24. (Fatec) A equação:
25.
(F. C. Chagas) A reação hipotética abaixo poderá ocorrer segundo o seguinte
mecanismo:
26.
(Vunesp) O NOCl se decompõe, em determinadas condições, em NO eCl2,
também gasosos. No estudo da cinética de decomposição do NOCl, foram obtidos os
seguintes dados:
Indicar a alternativa que
contém a expressão correta da velocidade e a constante de velocidade (K) para a
reação de decomposição do NOCl.
27.
Determinada reação química ocorre através de três etapas:
XY
+ R----- RY + X
RY
+ S----- RS + Y
RS
+ X----- RX + S
Examinando-se reagentes e
produtos dessas três etapas, conclui-se que age como catalisador a substância:
(a) R
(b) S
(c) Y
(d) RY
(e) RS
28.
Consegue-se aumentar a velocidade de reações que envolvem reagentes gasosos
por:
(a) aumento de temperatura.
(b) aumento de volume.
(c) aumento de concentração dos produtos.
(d) diminuição de pressão.
(e) diminuição da
concentração dos reagentes.
29.
O gráfico abaixo foi obtido no estudo da velocidade de uma reação química
realizada à temperatura e à pressão constantes.
Nesse gráfico, y pode
estar representando
(a) a concentração de um dos reagentes.
(b) a concentração de um dos produtos.
(c) a temperatura em que a reação é realizada.
(d) a pressão em que a temperatura é realizada.
(e) a relação
pressão/temperatura.
30.
A seqüência de reações representadas abaixo:
I. dióxido de carbono + água ----- sacarose + oxigênio
II. sacarose + água ----- etanol + dióxido de carbono
III. etanol + oxigênio ----- ácido acético + água
Ocorre em presença de
catalisadores. Clorofila é catalisador para:
(a) as reações I, II e III.
(b) as reações I e II, somente.
(c) as reações I e III, somente.
(d) a reação I, somente.
(e) a reação II somente.
31.
Uma dada reação química ocorre com velocidade cada vez maior à medida em que é
realizada com maiores concentrações iniciais dos reagentes. Este comportamento
decorre:
(a) do maior número de choques efetivos.
(b) da maior associação molecular.
(c) do aumento de energia cinética.
(d) do aumento do volume.
(e) da diminuição do grau
de dissociação.
32.
Escolha a alternativa que melhor completa a frase:
“A velocidade de uma reação química é dada
(a) pelo aumento da concentração de um produto por
unidade de tempo.”
(b) pelo tempo que uma reação química leva para
percorrer.”
(c) pela variação da energia cinética de um reagente
por unidade de tempo.”
(d) pela variação da energia potencial dos produtos por
unidade de tempo.”
(e) pelo aumento da
temperatura dos reagentes por unidade de tempo.
33.
O leite se estraga devido a reações químicas realizadas por
microorganismos. Um
meio de diminuir a velocidade dessas reações é fazer com que o leite seja:
(a) coado.
(b) mantido em temperaturas baixas.
(c) misturado com água destilada.
(d) guardado no escuro.
(e) embalado em
recipientes pequenos.
Instrução para a questão
de número 34.
Esta questão apresenta
três afirmativas que podem estar corretas ou incorretas. Responda-as,
obedecendo ao seguinte código:
(a) somente a afirmativa I é correta.
(b) somente a afirmativa II é correta.
(c) somente a afirmativa III é correta.
(d) somente as afirmativas II e III são corretas.
(e) as afirmativas I, II e
III são corretas.
34.
A formação de água a partir da mistura de hidrogênio gasoso com oxigênio gasoso
pode demorar ou, até mesmo, ser instantânea. Isto depende:
I. da forma do recipiente que recebe a mistura.
II. da temperatura.
III. da presença ou não de
catalisador.
35.
Considere a seguinte observação: as frutas amadurecem mais depressa à
temperatura ambiente do que à temperatura da geladeira.Das afirmações abaixo,
qual justifica essa observação?
(a) Com o decréscimo de temperatura os corpos diminuem
de volume.
(b) As reações químicas aumentam de velocidade com o
aumento da temperatura.
(c) A pressão de vapor da água a 25°C é maior do que a
pressão de vapor da água a °C.
(d) A ação catalítica de uma enzima depende do pH.
(e) O calor específico dos
corpos varia com a temperatura.
36.
Uma pizzaria pode conservar por mais tempo a mussarela que usa para preparar
suas pizzas se armazená-la
(a) em peça, à temperatura ambiente.
(b) fatiada, à temperatura ambiente.
(c) moída, à temperatura ambiente.
(d) em peça, sob refrigeração.
(e) fatiada, sob
refrigeração.
37.
À temperatura ambiente uma reação química ocorre com certa rapidez. Para torná-la
mais lenta pode-se:
I. realizada em temperatura inferiores à ambiente.
II. adicionar um
catalisador.
III. aumentar a
concentração dos reagentes.
Dessas afirmações,
somente:
(a) I é verdadeira.
(b) II é verdadeira.
(c) III é verdadeira.
(d) I e II são verdadeiras.
(e) II e III são
verdadeiras
38.
Uma batata picada cozinha mais rapidamente do que se estivesse inteira. Isso
acontece porque a batata, quando em pedaços, apresenta maior:
(a) temperatura.
(b) volume.
(c) massa.
(d) superfície de contato.
(e) quantidade de enzimas.
39.
Em qual das condições seguintes, a velocidade da reação é maior?
GABARITO